
Inhalt
1. Grundlagen
1.1 Kalilauge
1.2 Elektrolysevorgang
1.3 Effektivere Elektrolyse
1.3.1 Mehr Ortho- als Parawasserstoff
1.3.2 Mehr Monoatomarer – als Molekularer Wasserstoff
1.3.3 Wechseln der Spannung an den Polen
1.3.4 Spannung an nicht angeschlossenen Platten?
1.3.5 Mehr H² mit Minus an beiden Außenplatten?
1.3.6 Schmalere Abstand zwischen den Platten
1.3.7 Verhindern von Ionenbrücken
1.3.8 Stanley Meyer-Spaltung
2. Gefahrenhinweis
2.1 Knallgasreaktion
2.2 Elektrolyte
3. Knallgas/Brownsgas/HHO wo liegt der Unterschied?
4. Wieviel Energie brauche ich für die Herstellung?
4.1 Die angelegte Spannung im Idealfall
4.2 Die angelegte Spannung gemessen
4.3 Die Strommenge im Idealfall
4.4 Die Strommenge gemessen
4.5 Energiemenge je Liter HHO
5. Zellen Leckstrom messen
6. Buchempfehlungen
Autor: Arnd Koslowski
1. Grundlagen
Für die Wasserspaltung wird eine Elektrolysezelle benötigt. Ein einfacher Aufbau ist der Hoffmannsche Wasserzersetzungsapparat, der noch meist in Schulen Verwendung findet um die Zerlegung von Wasser durch Strom zu zeigen. Bei diesem wird an der Anode (Pluspol) Sauerstoff, und an der Kathode (Minuspol) Wasserstoff gespalten. Beide Gase sammeln sich im oberen Bereich des Rohres und können dort über einen Hahn entnommen, oder abgebrannt werden. Nachfolgend ein einfache Darstellung der Wasserelektrolyse.
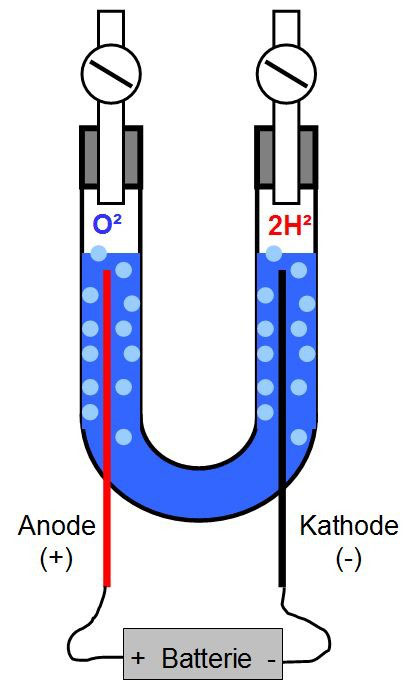
Ein Beschreibung der Wasserspaltung wird im Kapitel 1.2 beschrieben. Da hierbei Kalilauge angenommen wird, finden Sie eine kurze Erklärung dazu im Kap. 1.1. Weitere tiefergehende Details finden Sie in den folgenden Kapiteln 2. bis 6.
1.1 Kalilauge
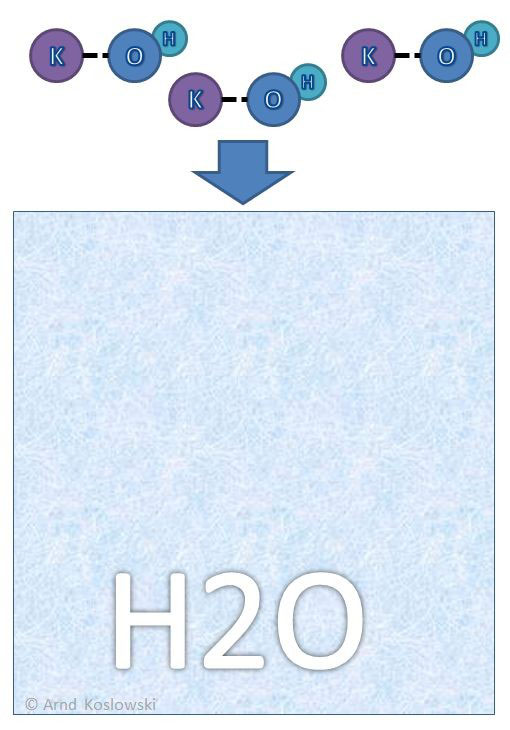 Wie kommt es dazu, dass sich KOH im Wasser löst und sich dort Ionen bilden?
Wie kommt es dazu, dass sich KOH im Wasser löst und sich dort Ionen bilden?
Wir betrachten im folgenden Beispiel nur das KOH, und nicht bereits vorhandene OH- oder H-Ionen im Wasser.
KOH kommt in Reinform als weißes trockenes Pulver vor. Die Kalium-Ionen sind im rechten Bild noch mit dem OH-Ionen als KOH verbunden und nicht gelöst. Das Wasser wird als blaues Feld mit “H2O” dargestellt.
Hier im Beispiel sehen wir 3 KOH-Moleküle, die in das Wasser geschüttet werden.
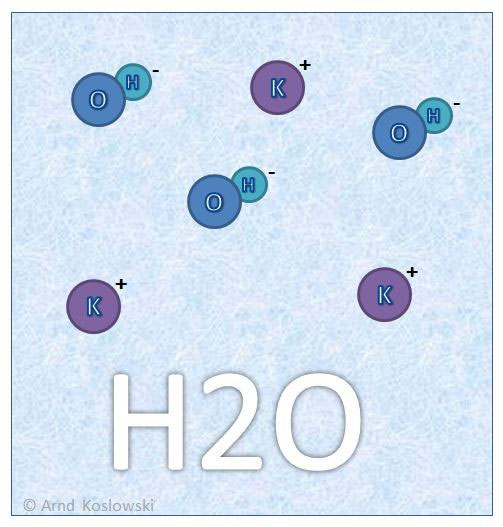 Nachdem das KOH in der wässrigen Lösung verteilt ist, wird durch Dissoziation im Wasser das KOH aufgetrennt in einen gleichen Anteil an Kalium- und OH-Ionen.
Nachdem das KOH in der wässrigen Lösung verteilt ist, wird durch Dissoziation im Wasser das KOH aufgetrennt in einen gleichen Anteil an Kalium- und OH-Ionen.
In unserem Fall haben wir nach dem Auflösen des KOH genau 3 Kalium-Ionen (positiv geladen), sowie 3 OH-Ionen (negativ geladen) die in der Lösung vorhanden sind.
1.2 Elektrolysevorgang
Der Elektrolysevorgang soll hier an Hand einer Elektrolyse mit einer Kalilauge (KOH gelöst in destilliertem Wasser) beschrieben werden. Die Beschreibung basiert auf Informationen aus dem Buch “Grundlagen der Chemie” von Cuny. Im Buch wird der Vorgang an Hand einer NaOH-Lösung beschrieben, während hier der Vorgang an einer KOH-Lösung erklärt wird. Beide Alkalimetalle haben jeweils nur ein OH-Molekül gebunden.
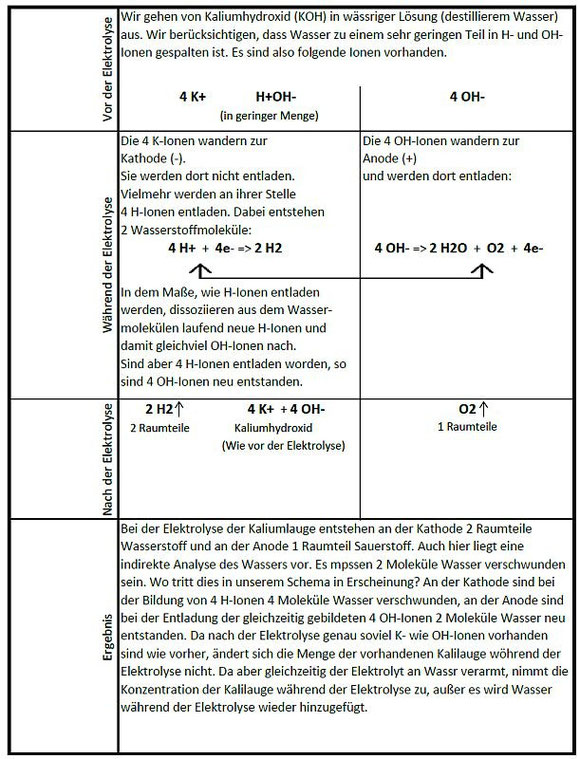
Bei der Elektrolyse einer Kalilauge bewirken somit die vielen zusätzlichen OH-Ionen einen erhöhten Elektronentransport, und damit einer effizienteren Elektrolyse. Je höher der Anteil der Lauge in der Lösung, umso mehr Strom kann fliessen.
1.3 Effektivere Elektrolyse
Bisher haben wir uns den Vorgang der bisher bekannten Elektrolyse angesehen und erklärt. Bei dieser wandern Ionen von einem zum anderen Pol hin und her, und erzeugen an den Polen Gas, Wasser oder Sauerstoff. Wie könnten wir es schaffen, dass mehr Energie in Form von Gas entsteht, als an elektrischer Energie reingesteckt wird?
1.3.1 Mehr Ortho- als Parawasserstoff
Wie im Kap. 4 in Wasserstoff-Grundlagen beschrieben, entsteht bei der Elektrolyse, je nach Temperatur in der Zelle und den verwendeten Materialien, ein erhöhter Ortho-Wasserstoffanteil. Wenn wir es schaffen diesen energiereicheren Wasserstoff zu verbrennen, sollte mehr Energie freigesetzt werden als beim verbrennen von Para-Wasserstoff.
Um das zu prüfen, könnte ein Heizaufbau wie im Kapitel 2. in Heizen mit Knallgas beschrieben helfen. Dabei sollte darauf geachtet werden, dass das erzeugte HHO mit möglichst wenig Metall in Berührung kommt bevor es verbrannt wird, um den Orthoanteil hoch zu halten.
Zuerst wird das entstandene HHO über einen Brenner verbrannt und die Energie bestimmt. Danach wir vor dem Brenner eine lange Edelstahlspirale verbaut, damit das HHO möglichst viel mit Metall in Berührung kommt um so einen hohen Parawasserstoffanteil zu erhalten. Wenn das Gas dann verbrannt wird, müsste die Energiemenge geringer als vorher mit hohen Orthoanteil.
1.3.2 Mehr Monoatomarer – als Molekularer Wasserstoff
Wie im Kap. 2 in Wasserstoff-Grundlagen beschrieben, entsteht bei der Elektrolyse zuerst Monoatomarer Wasserstoff. Da dieser sehr schnell einen Bindungspartner sucht, bildet sich sehr schnell Molekularer Wasserstoff H2. Wenn wir es schaffen kurz vor einem Brenner wieder mehr Monoatomaren energiereicheren Wasserstoff zu erzeugen, sollte mehr Energie beim verbrennen freigesetzt werden als beim verbrennen von Molekularen Wasserstoff.
Um das zu prüfen, könnte ein Heizaufbau wie im Kapitel 2. in Heizen mit Knallgas beschrieben helfen. Zuerst wird das entstandene HHO über einen Brenner verbrannt und die Energie bestimmt. Danach wird in einem 2. Schritt vor dem Brenner eine UV-Lampe oder eine HV-Kammer angebracht, durch die der Anteil an Monoatomaren Wasserstoff wieder erhöht wird.
1.3.3 Wechseln der Spannung an den Polen
Bei der Normalen Elektrolyse müssen die Ionen immer von einem Pol zum anderen wandern, um für einen Elektronenaustausch zu sorgen. Beim Transport von einer zur anderen Seite geht Energie verloren.
Wenn wir keine Gleichspannung an den Platten anlegen, sondern eine Wechselspannung, müssten die Ionen nicht mehr von einer zur anderen Platte wandern, sondern würden sich direkt nach dem Molekularen ersten Prozess kurz von der Platte lösen, um danach OHNE den langen Weg durch die Lösung, wieder an der gleichen Platte zu reagieren. Das würde bedeuten, dass an jeder Platte abwechselnd Sauer- und Wasserstoff entsteht.
Das ganze könnte noch effektiver sein, wenn die Frequenz der angelegten Wechselspannung angepasst wird. So wäre es möglich, genau die Frequenz zu ermitteln, bei der der chemische Prozess der Ionen- und Gasentstehung am effektivsten abläuft.
Möglich wäre so ein Versuch, indem ein Frequenzgenerator mit Wechselspannung verwendet wird, an dem ein passender Verstärker angeschlossen ist. Das Verstärkersignal muss so Spannungsstabil sein, das es nicht beim anschließen einer einfachen 2-Plattenanordnung zusammenbricht. Weiterhin sollte der Verstärker über ein breites Frequenzspektrum weg, eine hohe Frequenzstabilität haben.
Alternativ könnte auch eine erster Versuch mit einem Wechselspannungsnetzteil durchgeführt werden, das lediglich mit der Netzfrequenz arbeitet.
1.3.4 Spannung an nicht angeschlossenen Platten?
Es kommt immer wieder die Frage auf, ob und wieso an nicht angeschlossenen Elektrolyseplatten in einer Trockenzelle Gas entsteht. die Antwort ist einfach und lautet “Ja” es wird Gas produziert.
Der Effekt lässt sich erklären, wenn man die Elektrolysezelle wie einen Widerstand betrachtet, und wird im Bereich Trockenzelle im Kapitel 3.2 näher beschrieben. Dort im Kapitel 3.2.1 finden sie auch dieses Video das den Prozess anschaulich erklärt.
1.3.5 Mehr H² mit Minus an beiden Außenplatten?
Eine weitere Frage die öfters gestellt wird ist die, ob es etwas bringt bei einer Trockenzelle mit einen Pluspol in der Mitte vom Aufbau und zwei Minuspolen an den beiden Außenplatten mehr Wasserstoff herstellt wird. Grund soll sein, da am Minuspol der Wasserstoff entsteht.
Im folgenden Bild ist das grobe Schema einer Trockenzelle dargestellt, an der alle Platten entweder an Plus oder Minus angeschlossen sind.
Zu erkennen sind:
- Schwarze Striche = Metallplatten der Kammer
- Rote Plus und Schwarze Minus = Stromanschlüsse der Kammer
- “O” und “H²” = Gas, das an dieser Plattenseite entsteht
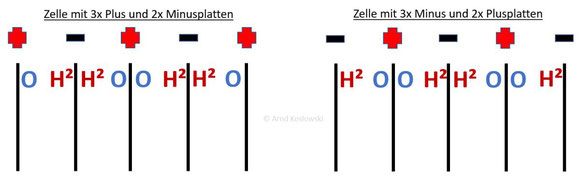
In beiden Fällen ist die Anzahl der Plattenseiten, die H² und O produzieren, identisch.
Daher wird nicht mehr Wasserstoff hergestellt, wenn mehr Minusplatten außen sind.
Zum Vergleich ist im folgenden Bild noch einmal das grobe Schema einer Trockenzelle dargestellt an der nicht Platten an Plus oder Minus angeschlossen sind, sondern zusätzlich neutrale Platten dazwischen geschaltet sind.
Zu erkennen sind:
- Schwarze Striche = Metallplatten der Kammer
- Rote Plus und Schwarze Minus = Stromanschlüsse der Kammer
- “N” = Neutrale Platten ohne eigenen Stromanschluss
- “O” und “H2” = Gas, das an dieser Plattenseite entsteht
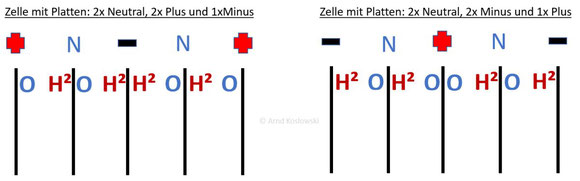
Auch hier ist in beiden Fällen die Anzahl der Plattenseiten die H² und O produzieren identisch. Daher wird auch hier nicht mehr Wasserstoff hergestellt, wenn mehr Minusplatten außen sind.
1.3.6 Schmalere Abstand zwischen den Platten
Ein Methode, den entstandenen Ionen ihren Weg zu erleichtern, wäre eine Verringerung des Abstandes zwischen den Platten. Je schmaler der Abstand, umso einfacher können die Ionen von einer zur anderen Seite wandern.
1.3.7 Verhindern von Ionenbrücken
Bei einer herkömmlichen Elektrolysezelle kann es an bestimmten Plattenstellen, wie Löchern in den Platten, zu der Bildung einer Ionenstrecke kommen, wenn Gleichspannung angelegt ist.
Bei einer Ionenstrecke entsteht eine Art Kanal in der Lösung, über den ein erhöhter Stromfluss stattfindet. Dadurch steigen die Verluste der ganzen Zelle.
Um das zu verhindern hat sich bautechnisch ein Gummiring bewährt, der in diese Löcher eingeführt wird und den Lochrand isoliert.
Eine Ionenstrecke kann auch anders verhindert werden. Durch wechseln der Plattenpolung oder zeitweise abschalten der Spannung, bricht diese Ionenstrecke immer wieder zusammen. Diejenigen unter Ihnen die sich auch mit der Herstellung von kolloidalem Silber bschäftigen, kennen dies Problem. Hier wird auch versucht diese Ionenstrecke zu verhindern, indem ein Polwechsel in der Elektronik mit eingebaut wird.
1.3.8 Stanley Meyer-Spaltung

Das es auch ohne Elektrolyse im herkömmlichen Sinn mit Ionenaustausch geht zeigt die Wasserspaltung nach Stanley Meyer. Hier kommt es darauf an, das die Wassermoleküle durch Spannungspulse in Richtung Platten ausgerichtet, und danach auseinandergerissen werden. Bei dieser Art der Spaltung nutzt man die Tatsache dass Wassermoleküle Dipole sind, und durch hohe elektrische Feldstärke ausgerichtet werden können.
Die Metallrohre die im Wasser sind, sollen im Gegensatz zur normalen Elektrolyse, möglichst keinen Strom leiten und eine Sperrschicht aufweisen. Ravi beschreibt diese Beschichtung der Rohre als “Konditionieren”
Mehr zur Stanley Meyer-Spaltung unter: Stanley Meyer
2. Gefahrenhinweis
Was gibt es bei der Elektrolyse, und dem Umgang mit Laugen und Knallgas zu beachten? Mehr in diesem Kapitel.
2.1 Knallgasreaktion
Die Knallgasreaktion ist eine detonationsartig und exotherm ablaufende Reaktion von Sauerstoff und Wasserstoff. Sie verläuft mit einer Detonationsgeschwindigkeit von 2820m/s, das entspricht der 8,2-fachen Schallgeschwindigkeit.
Ein kleiner Vergleich hierzu:
Benzin verbrennt mit etwa 30 m/s.
Eine Gewehrkugel erreicht etwa 700 m/s – 1m nach Verlassen des
Gewehrlaufes. Somit ist Knallgas 4x schneller als eine Gewehrkugel.
Deswegen ist Vorsicht geboten beim Bau von Elektrolyt-Zellen, Tanks und
Bubblern. Zur Sicherheit sollten im Aufbau ein Überdruckventil vorhanden sein, das bei Überdruck (>2 Bar) öffnet.
Der Umgang mit Knallgas erfordert ein hohes Maß an Sicherheit! Ein Gehörschutz, Schutzbrille, Schutzabschirmung (Makrolonplatte o.ä.) vor der Kammer und gute Lüftung des Raumes indem experimentiert wird, gehört dazu.
2.2 Elektrolyte
Als Elektrolyt wird meist KOH (Kaliumhydroxid) oder auch NaOH (Natriumhydroxid) verwendet. Sobald das Hydroxid in eine wässrige Läsung kommt, wird es im Wasser gelöst und bildet eine Lauge. Bei der Verwendung von KOH entsteht eine Kalilauge, und bei NaOH eine Natronlauge.
Die Konzentration der Lösung liegt bei ca 3%-28% Hydroxid-Anteil.
Bei einer Zelle, die mit Edelstahlplatten aufgebaut wurde, können durch das Elektrolyt aus dem Plattenmaterial sogenannte Chromate ausgelöst werden.
Beim Umgang mit der Elektrolytlösung ist zum einen wegen möglicher Chromate, und zum anderen wegen der Ätzwirkung vorsichtig geboten!
3. Knallgas / Brownsgas / HHO, wo liegt der Unterschied?
Es wird in der Literatur und im Internet erwähnt, dass Brownsgas / HHO ein anderes Gemisch ist, als das normale Knallgas. Bei meinen eigenen Versuchen konnte ich “bisher” keinen Unterschied feststellen oder messen, da mir genauere Meßgeräte und Analysegeräte fehlen.
Eigene Versuche haben gezeigt, dass das Gas aus einer Elektrolysezelle wie z.B. einer Trockenzelle (Drycell) die gleichen Reaktionen beim verbrennen zeigt, wie das Gas eines geliehenen Brownsgasgenerators. Bei beiden Gassorten konnte Stein mit Metall miteinander verschmolzen werden. Ebenso läßt sich Titan und andere Materialien mit beiden Gassorten genauso gut durchschmelzen.
Brownsgas und Brownsgasanlage
Wichtige Faktoren einer Brownsgasanlage und vom Brownsgas soll der höhere Energiegehalt des Gases sein, weil es aus einem größeren Anteil monoatomaren Wasser- und Sauerstoff bestehen soll. In den sehr guten Büchern Brownsgas-1 und -2 von Eagle-Research (auf Deutsch zu kaufen bei Brown’s-Gas.de) werden folgende Faktoren genannt die eine “normale” von einer Brownsgaszelle und BG-Produktion unterscheiden:
- Die Zelle bleibt wesentlich kälter (ca 20°C) als eine Trockenzelle die sich bis auf 60-80°C erhitzt.
- Die erzeugte Gasmenge ist doppelt so hoch, da die monoatomaren Gase mehr Raum benötigen, als molekulare Gase (Stichwort Molberechnung Gase)
- Die Strommenge die zur Herstellung des Gases benötigt wird ist wesentlich geringer, da keine Energie in Form von Wärme durch Endotherme Ionenreaktionen in der Lauge/Säure entstehen.
- Die Spannung/Zelle soll sehr gering sein (ca 0,9V-1V)
- Der Strom sollte möglichst hoch sein, bei geringer Spannung.
- Ideale Plattenabstand soll bei >3mm liegen.
- Es sollte deionisiertes Wasser verwendet werden.
Was ist dann normales Knallgas?
Im Gegensatz zu HHO oder Brownsgas wird Knallgas aus Wasserstoff- und Sauerstoffflaschen gemischt, oder es wird ein Wasserstoff-/Luftgemisch als Knallgas bezeichnet.
Wie geht es weiter?
Interessant wäre es zu erforschen, ob sich im Behälter aus atomarem Knallgas, molares Knallgas H2 und O2 bildet. Dies dürfte weniger Detonationskraft haben. Das wäre dann auch der entscheidende Unterschied – atomares einatomiges Knallgas versus molarem Knallgas – welches sich untereinander wieder verbunden und Moleküle gebildet hat.
Weiterhin sollte beim Zellenbau und Betrieb auf die oben genannten Faktoren einer Brownsgaszelle geachtet werden. Wenn einige Faktoren davon, wie weniger Wärmeentwicklung, weniger Energieverbrauch oder höhere Gasproduktion eintreten, haben wir die benötigte effektive Zelle für weitere Experimente.
Welche unterschiedlichen Wasserspaltungskammern es gibt, wird hier im Unterbereich Zellentypen näher beschrieben.
4. Wieviel Energie brauche ich für die Herstellung?
Wieviel HHO bei welchem Strom hergestellt wird, hängt von einer Vielzahl von Faktoren ab, unter anderem sind Dies:
- Leitfähigkeit der Lösung
- Anschliff der Platten
- Material der Platten
- Plattenfläche
- Plattenabstand
- Druck in der Zelle
- Temperatur der Zelle und der Lösung
Als grober Richtwert aus Versuchen kann ein Wert von ca. 220W – 110W/LPM (s. Maßeinheiten der Elektrolyse) angenommen werden.
Dabei ist darauf zu achten das bei direktem W/LPM-Vergleich von Zellen, der Druck und die Temperatur der verglichenen Zellen gleich sein sollten.
Bevor auf die Energiemenge (V/A) im Kapitel 4.5 je Zelle eingehen, ein paar paar dieser wichtigen Faktoren und Grundlagen hierzu.
Hinweis: Auf der folgenden Unterseite, wird auf die meist verwendeten Einheiten eingegangen: Maßeinheiten der Elektrolyse
4.1 Die angelegte Spannung im Idealfall
Um Wasser in seine Bestandteile zu zersetzen, wird eine bestimmte Spannung je Zelle benötigt. Diese liegt theoretisch zwischen 0,4V und 1,23V.
Die Werte sind:
Alkalischen Lösung (z.B. Wasser mit KOH) => 0,4V
Neutrale Lösung (pH-Neutrales Wasser) => 0,8V
Saure Lösung (z.B. Wasser mit Säure) => 1,23V
Diese Werte sind Werte, die für zwei Elektroden gelten die in einem Versuchsaufbau wie einem Reagenzglas stehen. Da neben der reinen Zersetzungspannung noch andere Verluste auftreten können, die die Spannung je Zelle erhöhen, sind die oberen Spannungsangaben Idealwerte. In der Praxis hat sich die Annahme mit 2V/Kammer bestätigt.
4.2 Die angelegte Spannung gemessen
Ich betreibe meine Zellen meist mit einer KOH-Lösung mit ca. 3-8% KOH in destilliertem Wasser. Die anlegte Spannung liegt hier bei ca. 2V/Kammer (Zelle), auch wenn diese theoretisch bei 0,4-1,2V liegen sollte.
4.3 Die Strommenge im Idealfall
Im Idealfall werden für die Herstellung von 1g Wasserstoff 96485 As benötigt. Bei einem Ampere Stromfluss dauert die Bildung von 11,2 Litern Wasserstoff 26 Stunden und 48 Minuten.
Da die meisten Trockenzellen mit mehr als 1 Ampere, und mit mehreren Kammern arbeiten, kann die Zeit auch verkürzt werden.
4.4 Die Strommenge gemessen
Neben der Spannung hängt auch die benötigte Strommenge von vielen Faktoren einer Zelle ab:
- Verwendete Dichtungsmaterial
- Anschliff der Platten
- Material der Platten
- Elektrolysefläche je Platte
Daher kann der benötigte Strom hier stark abweichen. Bei meiner Zelle liegt er bei einer reaktiven Fläche von 300x150mm bei ca. 24A, je nach KOH-Gehalt. (s. Heizen mit Wasserstoff)
4.5 Energiemenge je Liter HHO.
In einer idealen Zelle brauchen wir theoretisch für die Herstellung von 11,2 Litern Wasserstoff (ca. 16,8 Liter HHO):
Annahme 1,2V/Zelle:
1,2V x 96485 As = 115782 Ws = 32,16 Wh
Bei 1 Liter HHO wären es umgerechnet 32,16 Wh/16,8Liter = 1,91 Wh
Meine MiTHO-Zelle V01 (Download PDF) benötigte für 3,5 LPM eine Leistung von 777W, was 222W/LPM entspricht.
Die Herstellungszeit für einen Liter HHO beträgt:
60 Sekunden / 3,5 LPM = 17,14 Sekunden
Daraus ergibt sich für 1 Liter HHO eine Energiemenge von:
777 W * 17,14 Sek. = 13317,8 Ws = 3,7 Wh
Ab wann wäre eine Elektrolyse theoretisch so effektiv, das sie mehr Energie in Form von HHO herstellt, als an eingehenden Strom für die Elektrolyse benötigt wird? Lesen Sie dazu einen Ansatz unter Heizen mit Knallgas Kapitel 2. Versuch – Strom versus Knallgas
5. Zellen Leckstrom messen
Um sicherzugehen dass kein Leckstrom fliesst, sollte an die Zelle vor dem ersten Befüllen mit einer Lösung die gleiche Spannung angelegt werden, wie später im befüllten Zustand (also ca 2V/Zelle)
Messen sie nun mit dem Amperemeter (z.B. Digitalmessgerät) den Strom. Es sollte kein Strom fliessen. Falls dies doch der Fall ist, kann es sein dass der Stromfluss zustande kommt durch:
- Stromfluss zwischen Platten (Kurzschluss)
- Dichtungsmaterial leitet Strom
- Stromfluss über Gewindestangen (Kurzschluss)
Sie können danach mit einem Spannungsmesser prüfen, ob und wo Spannungen an den Platten anliegen. Im Idealfall sollten Sie nur eine Spannung an den am Stromkreislauf angeschlossenen Platten messen können. Wenn Sie an den anderen nicht angeschlossenen Platten eine Spannung messen können, leitet ihr Dichtungsmaterial, und Sie werden hier später im Betrieb Verluste haben.
Wenn der Wert zwischen zwei Platten wesentlich niedriger ist (Spannungsabfall) als bei den anderen Platten, berühren sich die Platten wahrscheinlich und sie sollten die Zelle zerlegen und dies nachprüfen. Möglich sind auch Metallreste zwischen den Platten die hier für einen Stromfluss sorgen können.
6. Buchempfehlungen
 Browns Gas – eine unerschöpfliche Energiequelle
Browns Gas – eine unerschöpfliche Energiequelle
In diesem Buch wird der energietechnisch interessierte Leser Schritt für Schritt an das Thema dieses immer noch geheimnisvollen Gases herangeführt. Browns Gas ist nicht nur unerschöpflich, sondern auch weitgehend unerforscht und unbekannt, obwohl es in den Bereich der Wasserstofftechnologien gehört. Gerade deshalb hat es der Autor unternommen, mit dem vorliegenden Werk ein erstes Signal zu setzen, das diesem Umstand abhelfen soll. Nach derzeitiger Information ist über Browns Gas bis jetzt noch nie in dieser Form ein Buch geschrieben worden.

Der Wassermotor – zum Selbernachbauen für Motorräder und Autos!
In diesem Buch werden zahlreiche Verfahren beschrieben, wie ein Benzinauto auf Mischtreibstoff mit Bio-Ethanol oder auf eine Mischung mit bis 80% Wasser und 20% Benzin umgestellt werden kann. Auch wer nur mit normalem Wasser fahren möchte, findet zahlreiche Möglichkeiten, um Wasser mit geringem Einsatz an elektrischer Energie in Wasserstoff und Sauerstoff aufzuspalten und das Fahrzeug dann mit reinem Wasserstoff zu betreiben.
Pläne zum Nachbau von Wassermotoren
Anleitung zum Selbstbau – Die jüngsten Meldungen über umgebaute Fahrzeuge, deren Motoren mit Wasser fahren, lassen immer mehr Umweltexperten und Autobenützer aufhorchen. Grossfirmen wie BMW und Mercedes entwickeln zwar Fahrzeuge für die Wasserstofftechnologie, doch zur elektrolytischen Herstellung von Wasserstoff braucht es nach gängiger Lehrmeinung immer noch mehr Energie, als eine einfache Lichtmaschine im Auto liefern kann. Dies änderte sich schlagartig, als überraschenderweise am 1. Februar 2002 … mehr lesen im Shop.






Hier liegt die Zukunft! Leider werden wir seit zwei Jahren mit einem C-Märchen
abgelenkt. Werde mich aber ab jetzt wieder mehr mit diesen Sachen beschäftigen.